Page sur les conductances
Conductivité électrique
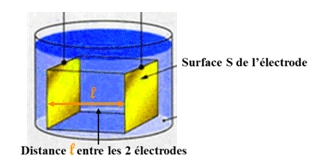
- On constate que :
- la conductance d'une solution électrolytique augmente lorsque la surface des plaques immergées augmente. G est proportionnel à S.
- la conductance d'une solution électrolytique augmente lorsque la distance entre les plaques immergées diminue. G est inversement proportionnel à l.
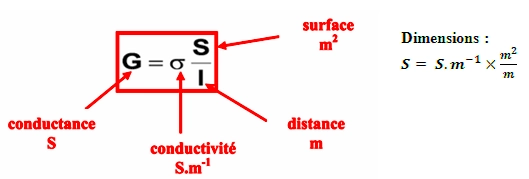
La conductivité électrique est l'inverse de la résistivité. Elle correspond à la conductance d'une portion de matériau de 1 m de longueur et de 1 m² de section.
- Infos
- Parmi les meilleurs conducteurs, il y a :
- Les métaux comme l'argent, le cuivre, l'or ou l'aluminium pour lesquels les porteurs de charge sont les électrons libres.
- Les solutions d'électrolytes ayant des ions en solution. Pour ces dernières, la valeur de la conductivité dépend de la nature des ions présents dans la solution et de leurs concentrations. La conductivité d'une solution peut être mesurée à l'aide d'un conductimètre.
Certains matériaux, comme les semi-conducteurs, ont une conductivité qui dépend d'autres conditions physiques, comme la température ou l'exposition à la lumière. Ces propriétés sont de plus en plus mises à profit pour réaliser des capteurs.
Unité
Dans le SI la conductivité est mesurée en S.m-1 (siemens par mètre), mais le plus souvent la mesure avec un conductimètre donne le résultat en mS.cm-1 (millisiemens par centimètre).
Utilisation courante
Largement utilisée en chimie, son unité dans le Système international d'unités (SI) est le siemens par mètre (1 S / m = A2.s3.m-3.kg-1). C'est le rapport de la densité de courant par l'intensité du champ électrique. C'est l'inverse de celle de la résistivité. Le symbole généralement utilisé pour désigner la conductivité est la lettre grecque sigma : σ, qui varie selon les matériaux de 108 S.m-1 à 10-22 S.m-1.
Autres utilisations de la conductivité
Dans le domaine de l'électrostatique et de la magnétostatique, on utilise plus généralement la conductivité électrique γ exprimée en (Ω.m)-1. L'unité de σ est homogène à celle de γ dans la mesure où le siemens est homogène à un Ω-1.
La conductivité d'une solution aqueuse permet d'estimer sa charge en ions, elle s'exprime généralement en μS / cm.
Expression
- Infos
- La loi de Nernst-Einstein permet de calculer la conductivité en fonction d'autres paramètres fondamentaux du matériau :
- σ = DZ²e²C / kBT
- Où
- D est le coefficient de diffusion de l'espèce chargée considérée
- Z est le nombre de charges portées par l'espèce
- e est la charge élémentaire, soit 1,602×10-19 C
- C est la concentration de l'espèce
- kB est la constante de Boltzmann, soit environ 1,3806*10-23 J.K-1
- T est la température absolue, exprimée en kelvins.
En chimie, la loi de Kohlrausch permet de calculer la conductivité en fonction de la concentration [Xi] des n ions Xi présents en solution. σ = zi * λi * Ci, avec Zi le nombre de charges de l'ion. Par exemple, Zi = 2, pour l'ion sulfate SO2-4.
La conductivité molaire ionique λi est une grandeur caractéristique d'un ion, c'est l'apport de l'ion à la conductivité électrique de la solution. Elle dépend notamment de la concentration, de la température, de la charge et de la taille de l'ion. Pour une solution, les conductivités s'additionnent : σ = Σi σi et la loi de Kohlrausch prend alors la forme générale suivante : σ = Σi zi * λi * Ci.
Conductance électrique
Soumis à une différence de potentiel, les corps laissent passer une certaine quantité de courant. La conductance est une représentation de cette capacité à laisser passer le courant. Elle est donc l'inverse de la résistance. G = 1 / R, on en déduit une autre formule électrique issue de la loi d'Ohm : G = I / U.
La conductance s'exprime dans le système international en siemens (symbole : S).
Dans une solution ionique : G = σ * S / L.
Conduction électrique dans les oxydes cristallins
Les oxydes cristallins, lorsqu'ils sont stoechiométriques, sont des isolants électriques : ils peuvent être décrits comme des cristaux quasi-ioniques, proches des sels, les charges sont liées aux atomes et ne sont pas mobiles. Les isolateurs électriques sont d'ailleurs fréquemment des céramiques ou des verres, notons cependant que les céramiques et les verres ne sont pas tous des oxydes et que les verres sont des solides mais amorphes.
Toutefois, les écarts à la stoechiométrie donnent naissance à des défauts ponctuels qui permettent une conduction électrique.
Conductivité ionique et électronique
- Infos
- Le courant électrique peut résulter du mouvement de deux types de charges.
- Les ions (anions et cations) : la migration des ions entraîne le déplacement de la charge associée.
- Les charges électroniques : électrons libres et trous d'électron.
- Infos
- Le déplacement des ions peut se faire de deux manières.
- Soit les ions se glissent entre les ions fixes du réseau, on parle de mouvement interstitiel.
- Soit il existe une lacune dans réseau, un ion du réseau peut alors sauter dans la position vide, on parle de mouvement lacunaire.
La charge transportée n'est pas la charge de l'ion elle-même, mais la différence entre le charge de l'ion et la charge que l'on aurait si le réseau était parfait à cet endroit, ce que l'on appelle la charge effective.
Par exemple : dans l'alumine Al2O3, l'ion aluminium dans le réseau a une charge 3+, la charge naturelle d'un site d'aluminium est donc 3+. Si maintenant le site est occupé par un ion de fer Fe2+ en substitution, alors le site est en déficit de charge positive, sa charge effective est donc -1. Dans la notation de Krüger et Vink, on note ceci FeAl'. Ainsi, un déplacement de l'ion positif Fe2+ correspond en fait au déplacement d'une charge négative dans le réseau.
Une position interstitielle est vide dans un cristal parfait, sa charge naturelle est donc nulle. Dans ce cas, la charge effective du site est la charge réelle de l'espèce qui l'occupe.
Un électron libre ou un trou d'électron sont considérés en position interstitielle. Leur déplacement suit une loi d'Ohm classique. Ils peuvent toutefois être capturés par un ion et modifier la charge locale, par exemple : MM + e' → MM'.
Ils se déplacent alors avec l'ion.
Le déplacement des ions peut être le seul fait de l'agitation thermique, on parle alors de diffusion, le courant électrique généré étant une conséquence de cette migration. Mais le déplacement peut aussi être créé par un gradient de potentiel chimique, un gradient de potentiel électrostatique.
Ecart à la stoechiométrie
Considérons un élément M, et l'oxyde de cet élément MnO2. On peut le décrire comme un sel, (Mz+n, O2-2).
L'écart à la stoechiométrie peut provenir de deux facteurs : l'équilibre thermodynamique avec l'atmosphère et le dopage.
L'équilibre thermodynamique avec l'atmosphère
L'oxyde et l'élément réduit sont en équilibre suivant la réaction d'oxydation, n M + O2 ↔ MnO2.
- Infos
- Selon la pression partielle de dioxygène et la température, l'équilibre se déplace d'un côté ou de l'autre. Dans les conditions où l'oxyde est stable, on va avoir des écarts à la stoechiométrie, la formule de l'oxyde devenant :
- Mn-xO2 : l'oxyde est dit déficitaire en cation.
- Mn+xO2 : l'oxyde est dit excédentaire en cation.
- MnO2-y : l'oxyde est dit déficitaire en anion.
- MnO2+y : l'oxyde est dit excédentaire en anion.
Dopage
L'oxyde peut contenir des éléments étrangers. Ces éléments peuvent être, des impuretés, introduites involontairement dans le procédé de fabrication ou bien présents dans le produit naturel, des ajouts volontaires pour modifier le comportement de l'oxyde.
Ces impuretés peuvent se glisser entre les ions du réseau, elles sont alors dites interstitielles, ou bien peuvent remplacer des atomes du réseau, elles sont alors dites en substitution.
Les éléments dopants peuvent introduire une charge effective non nulle. Cette création de charge va permettre une conductivité électrique, soit sous forme ionique, soit sous forme électronique, en captant des électrons d'autres sites créant ainsi des trous d'électron, ou bien en émettant des électrons libres.
Lois phénoménologique de la conduction
- Infos
- Si l'on soumet l'oxyde à une tension électrique, les charges relatives non nulles sont mises en mouvement. Ce faisant, cela crée un gradient de concentration, que la diffusion tend à niveler. Si l'on a un régime stationnaire, on peut décrire ce mouvement de manière globale statistique par la loi de Nernst-Einstein :
- vi = DiFi / kT.
- vi est la vitesse moyenne de l'espèce i considérée
- Di est le coefficient de diffusion de cette espèce i dans le cristal.
- Fi est la force électrostatique à laquelle est soumise l'espèce i.
- k est la constante de Boltzmann.
- T est la température absolue.
Cette loi est similaire à un frottement fluide : la vitesse, en régime stationnaire, est proportionnelle à la force.
- Infos
- On peut ainsi relier la conductivité électrique locale σi due à l'espèce i au coefficient de diffusion :
- σi = Diz²ie²ci / kT
- zi est la charge effective de l'espèce i nombre de charges.
- e est la charge élémentaire.
- ci est la concentration de l'espèce i à l'endroit considéré.
La conductivité électrique totale σ est la somme des conductivités électriques pour chaque espèce : σ = Σiσi.
Variable range hopping
Le Variable range hopping est une théorie en physique de la matière condensée qui décrit le mécanisme de conduction électrique que l'on observe dans les systèmes non cristallins appelés selon les situations, systèmes désordonnés, ou systèmes amorphes. Selon Nevill Mott, l'auteur de la théorie variable range hopping (VRH) établie en 1968-1969, ce mécanisme domine la conduction électrique à basse température dans les matériaux désordonnés, pour lesquels les états d'énergie sont généralement localisés au sens d'Anderson près du Niveau de Fermi. Lorsque le VRH est le mode de conduction dominant dans un système, alors la conductivité électrique de celui-ci suit la loi de Mott : σ = σoe-(T0 / T)1 / n + 1 où T0 est appelée la température de Mott et dépend de principalement de la longueur de localisation des porteurs de charges ainsi que de leur densité au niveau de Fermi et n représente la dimensionnalité du système considéré.
Le modèle de Mott
Pour parvenir à l'identification de ce mode de conduction, Mott analyse d'abord les mécanismes intervenant dans le transfert d'un électron d'un site vers un autre et construit son modèle en postulant que la conductivité est essentiellement gouvernée par les facteurs qui interviennent dans ce transfert. En assimilant celui-ci à une probabilité P, Mott considère que cette dernière n'est que la résultante de deux autres probabilités : la première est proportionnelle au facteur de Boltzmann : exp [-W / kT] et la seconde est proportionnelle au taux de recouvrement des fonctions d'onde associées aux sites intervenant dans le transfert des charges : exp [-2αR].
Dans ces expressions W = 3 / [4πR³ N (EF)] est l'énergie dépensée par l'électron pour qu'il puisse effectuer son saut, k est la constante de Boltzmann et 1 / α est le rayon de localisation des fonctions d'onde. N (EF) est connu comme étant la densité d'états au niveau de Fermi.
Ainsi la probabilité de transfert est donc la résultante de ces deux probabilités et est proportionnelle à : P ~ exp [-2αR - (W / kT)].
Un saut d'électron ne sera possible qui si cette probabilité est maximale et cela ne se produit que quand l'argument de la fonction exponentielle présente un minima, c'est-à-dire lorsque ∂ / ∂R [R -2αR - (W / kT)] = 0, qui donne : R = (T0 / T)¼, le report de cette expression de R dans la probabilité résultante P donne la conductivité de Mott.
Le VRH : une consommation intelligente de l'énergie
L'examen des expressions précédentes montre que l'énergie mise en jeu lors du transfert électronique d'un site vers un autre, est d'autant plus petite que la distance est longue. En effet, selon le VRH, les sauts effectués par une charge au sein d'un matériau sont optimisés non pas dans un espace à 3 dimensions (3D) mais dans un espace à quatre dimensions réparties en trois dimensions pour l'espace (3D) et une pour l'énergie (1D). Un saut entre deux sites très éloignés mais de niveaux énergétiques très proches pourrait être plus probable qu'un saut entre deux sites très proches mais d'énergies très différentes. Le coût d'un saut entre deux sites ne dépend plus seulement de la distance géométrique qui sépare ces deux sites mais aussi de la différence énergétique entre ces deux sites. Cette loi déroge à notre perception habituelle de la dépense d'énergie associée à tout déplacement. Ce type de conduction contraste avec la conduction classique dite par activation, qui fait que le porteur de charge ne se déplace que d'un site vers son proche voisin.